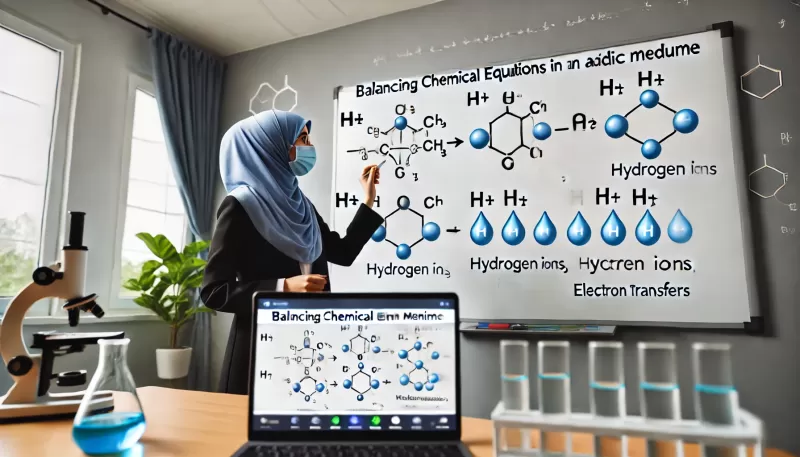
Щ…ЩҲШ§ШІЩҶШ© Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш§ШӘ ЩҒЩҠ ЩҲШіШ· ШӯЩ…Ш¶ЩҠ ЩҮЩҠ Щ…ЩҮШ§ШұШ© ШЈШіШ§ШіЩҠШ© Щ„Ш·Щ„Ш§ШЁ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШЎ Щ„ЩҒЩҮЩ… Ш§Щ„ШӘЩҒШ§Ш№Щ„Ш§ШӘ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠШ© Ш§Щ„ШӘЩҠ ШӘШӯШҜШ« ЩҒЩҠ ЩҲШіШ· ШӯЩ…Ш¶ЩҠШҢ ШӯЩҠШ« ШӘШ№ШӘЩ…ШҜ ЩҮШ°ЩҮ Ш§Щ„ШӘЩҒШ§Ш№Щ„Ш§ШӘ Ш№Щ„Щү ЩҲШ¬ЩҲШҜ ШЈЩҠЩҲЩҶШ§ШӘ Ш§Щ„ЩҮЩҠШҜШұЩҲШ¬ЩҠЩҶ (HвҒә). ШӘШіШ§Ш№ШҜ ЩҮШ°ЩҮ Ш§Щ„Щ…ЩҮШ§ШұШ© ЩҒЩҠ Ш¶Щ…Ш§ЩҶ ШЈЩҶ ЩғЩ„ Ш°ШұШ© ЩҲШҙШӯЩҶШ© ЩҒЩҠ Ш§Щ„ШӘЩҒШ§Ш№Щ„ Щ…ШӘЩҲШ§ШІЩҶШ© ШЁЩҠЩҶ Ш§Щ„Щ…ЩҲШ§ШҜ Ш§Щ„Щ…ШӘЩҒШ§Ш№Щ„Ш© ЩҲШ§Щ„ЩҶЩҲШ§ШӘШ¬. ЩҒЩҠ ЩҮШ°Ш§ Ш§Щ„ШҜШұШіШҢ ШіЩҶЩӮШҜЩ… ШҙШұШӯЩӢШ§ ШӘЩҒШөЩҠЩ„ЩҠЩӢШ§ Щ„Ш®Ш·ЩҲШ§ШӘ Щ…ЩҲШ§ШІЩҶШ© Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш§ШӘ ЩҒЩҠ ЩҲШіШ· ШӯЩ…Ш¶ЩҠ Щ…Ш№ ШЈЩ…Ш«Щ„Ш© Ш№Щ…Щ„ЩҠШ© Щ„ШӘЩҲШ¶ЩҠШӯ Ш§Щ„Щ…ЩҒЩҮЩҲЩ….
Щ…Ш§ ЩҮЩҲ Ш§Щ„ЩҲШіШ· Ш§Щ„ШӯЩ…Ш¶ЩҠШҹ
Ш§Щ„ЩҲШіШ· Ш§Щ„ШӯЩ…Ш¶ЩҠ ЩҮЩҲ Ш§Щ„ЩҲШіШ· Ш§Щ„Ш°ЩҠ ЩҠШӯШӘЩҲЩҠ Ш№Щ„Щү ШӘШұЩғЩҠШІ Ш№Ш§Щ„ЩҚ Щ…ЩҶ ШЈЩҠЩҲЩҶШ§ШӘ Ш§Щ„ЩҮЩҠШҜШұЩҲШ¬ЩҠЩҶ (HвҒә). ШӘЩҸШіШӘШ®ШҜЩ… ЩҮШ°ЩҮ Ш§Щ„ШЈЩҠЩҲЩҶШ§ШӘ Щ„Щ…ЩҲШ§ШІЩҶШ© Ш°ШұШ§ШӘ Ш§Щ„ЩҮЩҠШҜШұЩҲШ¬ЩҠЩҶ ЩҒЩҠ Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш© Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠШ©. Щ…ЩҶ ШЈЩ…Ш«Щ„Ш© Ш§Щ„ШЈЩҲШіШ§Ш· Ш§Щ„ШӯЩ…Ш¶ЩҠШ©: ШӯЩ…Ш¶ Ш§Щ„ЩғШЁШұЩҠШӘЩҠЩғ (HвӮӮSOвӮ„)ШҢ ЩҲШӯЩ…Ш¶ Ш§Щ„ЩҮЩҠШҜШұЩҲЩғЩ„ЩҲШұЩҠЩғ (HCl)ШҢ ЩҲШӯЩ…Ш¶ Ш§Щ„ЩҶЩҠШӘШұЩҠЩғ (HNOвӮғ).
Ш®Ш·ЩҲШ§ШӘ Щ…ЩҲШ§ШІЩҶШ© Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш§ШӘ ЩҒЩҠ ЩҲШіШ· ШӯЩ…Ш¶ЩҠ
1. ЩғШӘШ§ШЁШ© Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш© ШәЩҠШұ Ш§Щ„Щ…ШӘЩҲШ§ШІЩҶШ©
ШӘШЁШҜШЈ Ш№Щ…Щ„ЩҠШ© Ш§Щ„Щ…ЩҲШ§ШІЩҶШ© ШЁЩғШӘШ§ШЁШ© Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш© Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠШ© ШәЩҠШұ Ш§Щ„Щ…ШӘЩҲШ§ШІЩҶШ©. ЩҠШ¬ШЁ ШЈЩҶ ШӘШ¶Щ… Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш© Ш¬Щ…ЩҠШ№ Ш§Щ„Щ…ЩҲШ§ШҜ Ш§Щ„Щ…ШӘЩҒШ§Ш№Щ„Ш© ЩҲШ§Щ„ЩҶЩҲШ§ШӘШ¬ ШҜЩҲЩҶ Ш§Щ„Ш§ЩҮШӘЩ…Ш§Щ… ЩҒЩҠ ЩҮШ°ЩҮ Ш§Щ„Щ…ШұШӯЩ„Ш© ШЁШӘЩҲШ§ШІЩҶ Ш§Щ„Ш°ШұШ§ШӘ ШЈЩҲ Ш§Щ„ШҙШӯЩҶШ§ШӘ.
2. ШӘЩӮШіЩҠЩ… Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш© ШҘЩ„Щү ЩҶШөЩҒЩҠЩҶ: ЩҶШөЩҒ Ш§Щ„ШӘШЈЩғШіШҜ ЩҲЩҶШөЩҒ Ш§Щ„Ш§Ш®ШӘШІШ§Щ„
ЩҒЩҠ ЩҮШ°ЩҮ Ш§Щ„Ш®Ш·ЩҲШ©ШҢ ЩҠШӘЩ… ШӘЩӮШіЩҠЩ… Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш© ШҘЩ„Щү ЩҶШөЩҒЩҠЩҶ:
- ЩҶШөЩҒ Ш§Щ„ШӘШЈЩғШіШҜ: Ш§Щ„Ш№Щ…Щ„ЩҠШ© Ш§Щ„ШӘЩҠ ШӘЩҒЩӮШҜ ЩҒЩҠЩҮШ§ Щ…Ш§ШҜШ© Щ…Ш§ ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ.
- ЩҶШөЩҒ Ш§Щ„Ш§Ш®ШӘШІШ§Щ„: Ш§Щ„Ш№Щ…Щ„ЩҠШ© Ш§Щ„ШӘЩҠ ШӘЩғШӘШіШЁ ЩҒЩҠЩҮШ§ Щ…Ш§ШҜШ© Щ…Ш§ ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ.
3. Щ…ЩҲШ§ШІЩҶШ© Ш¬Щ…ЩҠШ№ Ш§Щ„Ш°ШұШ§ШӘ ШЁШ§ШіШӘШ«ЩҶШ§ШЎ Ш§Щ„ШЈЩғШіШ¬ЩҠЩҶ ЩҲШ§Щ„ЩҮЩҠШҜШұЩҲШ¬ЩҠЩҶ
ШЁШ№ШҜ ШӘЩӮШіЩҠЩ… Ш§Щ„ШӘЩҒШ§Ш№Щ„ ШҘЩ„Щү ЩҶШөЩҒЩҠЩҶШҢ ЩҠШӘЩ… Щ…ЩҲШ§ШІЩҶШ© Ш§Щ„Ш№ЩҶШ§ШөШұ Ш§Щ„ШЈШ®ШұЩү ЩҒЩҠ Ш§Щ„ШӘЩҒШ§Ш№Щ„ (ШЁШ§ШіШӘШ«ЩҶШ§ШЎ Ш§Щ„ШЈЩғШіШ¬ЩҠЩҶ ЩҲШ§Щ„ЩҮЩҠШҜШұЩҲШ¬ЩҠЩҶ) Щ„Ш¶Щ…Ш§ЩҶ ШЈЩҶ ЩғЩ„ Ш№ЩҶШөШұ Щ…ШӘШіШ§ЩҲЩҚ Ш№Щ„Щү Ш¬Ш§ЩҶШЁЩҠ Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш©.
4. Щ…ЩҲШ§ШІЩҶШ© Ш§Щ„ШЈЩғШіШ¬ЩҠЩҶ ШЁШ§ШіШӘШ®ШҜШ§Щ… Ш¬ШІЩҠШҰШ§ШӘ Ш§Щ„Щ…Ш§ШЎ (HвӮӮO)
Щ„Щ…ЩҲШ§ШІЩҶШ© Ш°ШұШ§ШӘ Ш§Щ„ШЈЩғШіШ¬ЩҠЩҶШҢ ЩҠШӘЩ… ШҘШ¶Ш§ЩҒШ© Ш¬ШІЩҠШҰШ§ШӘ Ш§Щ„Щ…Ш§ШЎ ШҘЩ„Щү Ш§Щ„Ш¬ЩҮШ© Ш§Щ„ШӘЩҠ ШӘЩҒШӘЩӮШұ ШҘЩ„Щү Ш§Щ„ШЈЩғШіШ¬ЩҠЩҶ. Ш№Щ„Щү ШіШЁЩҠЩ„ Ш§Щ„Щ…Ш«Ш§Щ„ШҢ ШҘШ°Ш§ ЩғШ§ЩҶ ЩҮЩҶШ§Щғ ЩҶЩӮШө ЩҒЩҠ Ш§Щ„ШЈЩғШіШ¬ЩҠЩҶ ЩҒЩҠ Ш¬Ш§ЩҶШЁ ЩҲШ§ШӯШҜ Щ…ЩҶ Ш§Щ„ШӘЩҒШ§Ш№Щ„ШҢ ШӘШӘЩ… ШҘШ¶Ш§ЩҒШ© Ш¬ШІЩҠШҰШ§ШӘ Ш§Щ„Щ…Ш§ШЎ ШҘЩ„Щү ЩҮШ°Ш§ Ш§Щ„Ш¬Ш§ЩҶШЁ.
5. Щ…ЩҲШ§ШІЩҶШ© Ш§Щ„ЩҮЩҠШҜШұЩҲШ¬ЩҠЩҶ ШЁШ§ШіШӘШ®ШҜШ§Щ… ШЈЩҠЩҲЩҶШ§ШӘ Ш§Щ„ЩҮЩҠШҜШұЩҲШ¬ЩҠЩҶ (HвҒә)
ЩҒЩҠ ЩҲШіШ· ШӯЩ…Ш¶ЩҠШҢ ЩҠШӘЩ… Ш§ШіШӘШ®ШҜШ§Щ… ШЈЩҠЩҲЩҶШ§ШӘ Ш§Щ„ЩҮЩҠШҜШұЩҲШ¬ЩҠЩҶ (HвҒә) Щ„Щ…ЩҲШ§ШІЩҶШ© Ш°ШұШ§ШӘ Ш§Щ„ЩҮЩҠШҜШұЩҲШ¬ЩҠЩҶ. Ш№Щ„Щү ШіШЁЩҠЩ„ Ш§Щ„Щ…Ш«Ш§Щ„ШҢ ШҘШ°Ш§ ЩғШ§ЩҶ ЩҮЩҶШ§Щғ ЩҶЩӮШө ЩҒЩҠ Ш§Щ„ЩҮЩҠШҜШұЩҲШ¬ЩҠЩҶШҢ ШӘШӘЩ… ШҘШ¶Ш§ЩҒШ© ШЈЩҠЩҲЩҶШ§ШӘ Ш§Щ„ЩҮЩҠШҜШұЩҲШ¬ЩҠЩҶ Щ„ШӘШ№ЩҲЩҠШ¶ ЩҮШ°Ш§ Ш§Щ„ЩҶЩӮШө.
6. Щ…ЩҲШ§ШІЩҶШ© Ш§Щ„ШҙШӯЩҶШ§ШӘ ШЁШ§ШіШӘШ®ШҜШ§Щ… Ш§Щ„ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ
Ш§Щ„Ш®Ш·ЩҲШ© Ш§Щ„ШӘШ§Щ„ЩҠШ© ЩҮЩҠ Щ…ЩҲШ§ШІЩҶШ© Ш§Щ„ШҙШӯЩҶШ§ШӘ Ш§Щ„ЩғЩҮШұШЁШ§ШҰЩҠШ© ЩҒЩҠ Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш© Ш№ЩҶ Ш·ШұЩҠЩӮ ШҘШ¶Ш§ЩҒШ© Ш§Щ„ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ ШҘЩ„Щү Ш§Щ„Ш¬ЩҮШ© Ш§Щ„Щ…ЩҶШ§ШіШЁШ©. ШӘШ¶Ш§ЩҒ Ш§Щ„ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ ШҘЩ„Щү ЩҶШөЩҒ Ш§Щ„ШӘШЈЩғШіШҜ Щ„ШЈЩҶ Ш§Щ„Щ…Ш§ШҜШ© ЩҮЩҶШ§Щғ ШӘЩҒЩӮШҜ ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘШҢ ШЁЩҠЩҶЩ…Ш§ ШӘШ¶Ш§ЩҒ ШҘЩ„Щү ЩҶШөЩҒ Ш§Щ„Ш§Ш®ШӘШІШ§Щ„ Щ„ШЈЩҶ Ш§Щ„Щ…Ш§ШҜШ© ШӘЩғШӘШіШЁ ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ.
7. Ш¬Щ…Ш№ ЩҶШөЩҒЩҠ Ш§Щ„ШӘЩҒШ§Ш№Щ„ Щ…Ш№ЩӢШ§
ШЁШ№ШҜ Щ…ЩҲШ§ШІЩҶШ© ЩғЩ„ ЩҶШөЩҒ ШӘЩҒШ§Ш№Щ„ ШЁШҙЩғЩ„ Щ…ЩҶЩҒШөЩ„ШҢ ЩҠШӘЩ… Ш¬Щ…Ш№ ЩҶШөЩҒЩҠ Ш§Щ„ШӘЩҒШ§Ш№Щ„ Щ…Ш№ЩӢШ§ Щ„Щ„ШӘШЈЩғШҜ Щ…ЩҶ ШЈЩҶ Ш§Щ„ШҙШӯЩҶШ§ШӘ Щ…ШӘЩҲШ§ШІЩҶШ© ШЁЩҠЩҶ Ш§Щ„Щ…ЩҲШ§ШҜ Ш§Щ„Щ…ШӘЩҒШ§Ш№Щ„Ш© ЩҲШ§Щ„ЩҶЩҲШ§ШӘШ¬.
8. Щ…ШұШ§Ш¬Ш№Ш© Ш§Щ„ШӘЩҒШ§Ш№Щ„ Ш§Щ„Щ…ШӘЩҲШ§ШІЩҶ
Ш§Щ„Ш®Ш·ЩҲШ© Ш§Щ„ШЈШ®ЩҠШұШ© ЩҮЩҠ Ш§Щ„ШӘШЈЩғШҜ Щ…ЩҶ ШЈЩҶ ЩғЩ„ Ш°ШұШ© ЩҲШҙШӯЩҶШ© ЩҒЩҠ Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш© Щ…ШӘЩҲШ§ШІЩҶШ© ШЁШҙЩғЩ„ ШөШӯЩҠШӯ. ШҘШ°Ш§ ЩғШ§ЩҶШӘ Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш© ШӘШӯШӘЩҲЩҠ Ш№Щ„Щү Ш°ШұШ§ШӘ ШЈЩҲ ШҙШӯЩҶШ§ШӘ ШәЩҠШұ Щ…ШӘЩҲШ§ШІЩҶШ©ШҢ ШӘШӘЩ… Щ…ШұШ§Ш¬Ш№Ш© Ш§Щ„Ш®Ш·ЩҲШ§ШӘ Ш§Щ„ШіШ§ШЁЩӮШ© Щ„Ш¶Щ…Ш§ЩҶ Ш§Щ„ШӘЩҲШ§ШІЩҶ.
Щ…Ш«Ш§Щ„ Ш№Щ…Щ„ЩҠ Ш№Щ„Щү Щ…ЩҲШ§ШІЩҶШ© Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш§ШӘ ЩҒЩҠ ЩҲШіШ· ШӯЩ…Ш¶ЩҠ
Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш© ШәЩҠШұ Ш§Щ„Щ…ШӘЩҲШ§ШІЩҶШ©:
Ш§Щ„Ш®Ш·ЩҲШ© Ш§Щ„Ш®Ш§Щ…ШіШ©: Щ…ЩҲШ§ШІЩҶШ© Ш§Щ„ШҙШӯЩҶШ§ШӘ ШЁШ§ШіШӘШ®ШҜШ§Щ… Ш§Щ„ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ
- ЩҒЩҠ ЩҶШөЩҒ Ш§Щ„ШӘШЈЩғШіШҜШҢ Щ„Ш§ ШӘЩҲШ¬ШҜ ШӯШ§Ш¬Ш© Щ„ШҘШ¶Ш§ЩҒШ© Ш§Щ„ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ Щ„ШЈЩҶ Ш§Щ„ШҙШӯЩҶШ© Щ…ШӘЩҲШ§ШІЩҶШ©.
- ЩҒЩҠ ЩҶШөЩҒ Ш§Щ„Ш§Ш®ШӘШІШ§Щ„ШҢ ЩҠШӘЩ… ШҘШ¶Ш§ЩҒШ© 5 ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ ШҘЩ„Щү Ш§Щ„Ш¬Ш§ЩҶШЁ Ш§Щ„ШЈЩҠШіШұ Щ„Щ…ЩҲШ§ШІЩҶШ© Ш§Щ„ШҙШӯЩҶШ§ШӘ.
Ш§Щ„Ш®Ш·ЩҲШ© Ш§Щ„ШіШ§ШҜШіШ©: Ш¬Щ…Ш№ ЩҶШөЩҒЩҠ Ш§Щ„ШӘЩҒШ§Ш№Щ„ Щ…Ш№ЩӢШ§
- ЩҠШӘЩ… Ш¬Щ…Ш№ ЩҶШөЩҒЩҠ Ш§Щ„ШӘЩҒШ§Ш№Щ„ Щ…Ш№ЩӢШ§ШҢ ЩҲЩҠШӘЩ… Ш§Щ„ШӘШЈЩғШҜ Щ…ЩҶ ШЈЩҶ Ш§Щ„ШҙШӯЩҶШ§ШӘ ЩҲШ§Щ„ШҘЩ„ЩғШӘШұЩҲЩҶШ§ШӘ Щ…ШӘЩҲШ§ШІЩҶШ©.
Ш§Щ„Ш®Ш·ЩҲШ© Ш§Щ„ШіШ§ШЁШ№Ш©: Щ…ШұШ§Ш¬Ш№Ш© Ш§Щ„ШӘЩҒШ§Ш№Щ„ Ш§Щ„Щ…ШӘЩҲШ§ШІЩҶ
- ШЁШ№ШҜ Ш¬Щ…Ш№ ЩҶШөЩҒЩҠ Ш§Щ„ШӘЩҒШ§Ш№Щ„ШҢ ЩҠШӘШЈЩғШҜ Ш§Щ„Ш·Ш§Щ„ШЁ Щ…ЩҶ ШӘЩҲШ§ШІЩҶ Ш¬Щ…ЩҠШ№ Ш§Щ„Ш°ШұШ§ШӘ ЩҲШ§Щ„ШҙШӯЩҶШ§ШӘ. Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш© Ш§Щ„Щ…ШӘЩҲШ§ШІЩҶШ© ЩҮЩҠ:
ШЈЩҮЩ…ЩҠШ© Щ…ЩҲШ§ШІЩҶШ© Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш§ШӘ ЩҒЩҠ ЩҲШіШ· ШӯЩ…Ш¶ЩҠ
1. ЩҒЩҮЩ… Ш§Щ„Ш№Щ…Щ„ЩҠШ§ШӘ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠШ©:
Щ…ЩҲШ§ШІЩҶШ© Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш§ШӘ ЩҒЩҠ ЩҲШіШ· ШӯЩ…Ш¶ЩҠ ШӘШіШ§Ш№ШҜ Ш§Щ„Ш·Щ„Ш§ШЁ Ш№Щ„Щү ЩҒЩҮЩ… ЩғЩҠЩҒЩҠШ© ШӯШҜЩҲШ« Ш§Щ„ШӘЩҒШ§Ш№Щ„Ш§ШӘ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠШ© ШЁШҙЩғЩ„ ШҜЩӮЩҠЩӮ. ЩғЩ…Ш§ ШЈЩҶ ЩҮШ°ЩҮ Ш§Щ„Щ…ЩҮШ§ШұШ© ШЈШіШ§ШіЩҠШ© ЩҒЩҠ Ш§Щ„Щ…Ш®ШӘШЁШұШ§ШӘ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠШ© ЩҲЩҒЩҠ Ш§Щ„Ш№ШҜЩҠШҜ Щ…ЩҶ Ш§Щ„ШөЩҶШ§Ш№Ш§ШӘ.
2. Ш§Щ„ШӘШ·ШЁЩҠЩӮШ§ШӘ Ш§Щ„Ш№Щ…Щ„ЩҠШ©:
ШӘШіШӘШ®ШҜЩ… Щ…ЩҲШ§ШІЩҶШ© Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш§ШӘ ЩҒЩҠ Ш§Щ„ШЈЩҲШіШ§Ш· Ш§Щ„ШӯЩ…Ш¶ЩҠШ© ЩҒЩҠ Щ…Ш¬Ш§Щ„Ш§ШӘ Щ…Ш«Щ„ ШөЩҶШ§Ш№Ш© Ш§Щ„ШЁШ·Ш§ШұЩҠШ§ШӘШҢ Щ…Ш№Ш§Щ„Ш¬Ш© Ш§Щ„Щ…ЩҠШ§ЩҮШҢ ЩҲШ§Щ„ШӘЩҒШ§Ш№Щ„Ш§ШӘ Ш§Щ„ШөЩҶШ§Ш№ЩҠШ© Ш§Щ„Щ…Ш®ШӘЩ„ЩҒШ©.
3. ШӘШ·ЩҲЩҠШұ Ш§Щ„Щ…ЩҮШ§ШұШ§ШӘ Ш§Щ„ШЈЩғШ§ШҜЩҠЩ…ЩҠШ©:
ШҘШӘЩӮШ§ЩҶ ЩҮШ°ЩҮ Ш§Щ„Щ…ЩҮШ§ШұШ© ЩҠШ№ШІШІ ЩӮШҜШұШ© Ш§Щ„Ш·Щ„Ш§ШЁ Ш№Щ„Щү ШӯЩ„ Ш§Щ„Щ…ШіШ§ШҰЩ„ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠШ© Ш§Щ„Щ…Ш№ЩӮШҜШ© ЩҲЩҠШІЩҠШҜ Щ…ЩҶ ЩҒЩҮЩ…ЩҮЩ… Щ„Щ„Ш№Щ„Ш§ЩӮШ§ШӘ ШЁЩҠЩҶ Ш§Щ„Щ…ЩҲШ§ШҜ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШҰЩҠШ©.
ШӘЩҲШ§ШөЩ„ Щ…Ш№ЩҶШ§ Щ„Щ„ШӯШөЩҲЩ„ Ш№Щ„Щү ШЈЩҒШ¶Щ„ ШҜШұЩҲШі ЩҒЩҠ Щ…ЩҲШ§ШІЩҶШ© Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш§ШӘ
ШҘШ°Ш§ ЩғЩҶШӘ ШӘШұШәШЁ ЩҒЩҠ ШӘШ№Щ„Щ… Ш§Щ„Щ…ШІЩҠШҜ ШӯЩҲЩ„ Щ…ЩҲШ§ШІЩҶШ© Ш§Щ„Щ…Ш№Ш§ШҜЩ„Ш§ШӘ ЩҒЩҠ ЩҲШіШ· ШӯЩ…Ш¶ЩҠ ЩҲШӘШ·ЩҲЩҠШұ Щ…ЩҮШ§ШұШ§ШӘЩғ ЩҒЩҠ Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШЎШҢ ЩҶШӯЩҶ ЩҮЩҶШ§ Щ„Щ…ШіШ§Ш№ШҜШӘЩғ. ЩҶЩӮШҜЩ… ШҜШұЩҲШіЩӢШ§ Ш®ШөЩҲШөЩҠШ© Щ…ШӘШ®ШөШөШ© ШӘШұЩғШІ Ш№Щ„Щү ШӘЩҲЩҒЩҠШұ ШҙШұШӯ Щ…ЩҒШөЩ„ ЩҲЩ…Щ…Ш§ШұШіШ© Ш№Щ…Щ„ЩҠШ©. ШӘЩҲШ§ШөЩ„ Щ…Ш№ЩҶШ§ Ш№ШЁШұ ЩҲШ§ШӘШі Ш§ШЁ Ш§Щ„ШўЩҶ Щ„Щ„ШӯШөЩҲЩ„ Ш№Щ„Щү ШӯШөШ© ШӘШ¬ШұЩҠШЁЩҠШ© Щ…Ш¬Ш§ЩҶЩҠШ© ЩҲШ¶Щ…Ш§ЩҶ Ш§Щ„ЩҶШ¬Ш§Шӯ ЩҒЩҠ Щ…Ш§ШҜШ© Ш§Щ„ЩғЩҠЩ…ЩҠШ§ШЎ!


