جهد الخلية هو أحد المفاهيم الأساسية في الكيمياء الكهروكيميائية، ويُشير إلى الفرق في الجهد الكهربائي بين قطبين في خلية كهروكيميائية. يعتمد جهد الخلية على طبيعة المواد المتفاعلة وعلى التفاعلات الأكسدة والاختزال التي تحدث في الخلية. في هذا المقال، سنتناول كيفية حساب جهد الخلية باستخدام القوانين والمعادلات الأساسية.
ما هو جهد الخلية؟
جهد الخلية هو القوة الدافعة الكهربائية التي تنتج عن الفرق في الإمكانات الكهربائية بين قطبي الخلية (المصعد والمهبط). يتم حساب هذا الجهد بناءً على جهد الاختزال القياسي لكل من المصعد والمهبط. إذا كان الجهد إيجابيًا، فإن التفاعل الكيميائي يحدث بشكل تلقائي، مما يولد تيارًا كهربائيًا.
معادلة حساب جهد الخلية
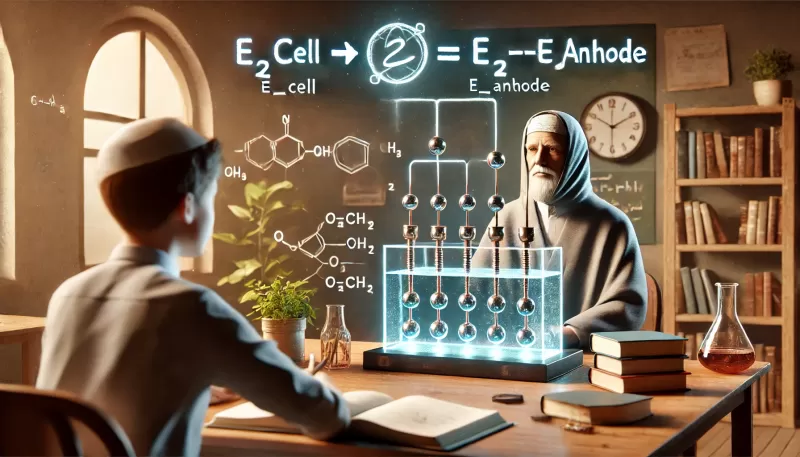
يتم حساب جهد الخلية باستخدام معادلة بسيطة تعتمد على جهود الاختزال القياسية (Standard Reduction Potentials) لكل من المصعد والمهبط.
- E_{\text{cell}}: جهد الخلية.
- E_{\text{cathode}}: جهد الاختزال القياسي عند المهبط.
- E_{\text{anode}}: جهد الاختزال القياسي عند المصعد.
خطوات حساب جهد الخلية
- تحديد تفاعلات الأكسدة والاختزال:
- قم بتحديد التفاعل الذي يحدث في المصعد (الأكسدة) والتفاعل الذي يحدث في المهبط (الاختزال). يمكنك الاستعانة بالجدول الدوري أو سلسلة النشاط الكيميائي.
- الحصول على جهود الاختزال القياسية:
- استخرج القيم من جدول جهود الاختزال القياسية لكل من المصعد والمهبط. يجب أن تكون هذه القيم في وحدات الفولت (V).
- تطبيق المعادلة:
- استخدم معادلة جهد الخلية لحساب الفرق بين جهد المهبط وجهد المصعد. يكون جهد المهبط أكبر من جهد المصعد في الخلايا الجلفانية.
مثال على حساب جهد الخلية
العوامل المؤثرة على جهد الخلية
هناك عدة عوامل قد تؤثر على جهد الخلية، منها:
- درجة الحرارة:
- زيادة درجة الحرارة قد تؤدي إلى تغير في جهد الخلية. جهد الخلية يُحسب عادة عند درجة حرارة قياسية (25 درجة مئوية).
- تركيز المواد المتفاعلة:
- قد يؤدي تغيير تركيز الأيونات في المحلول إلى تغيير جهد الخلية. إذا زاد تركيز المواد المتفاعلة، قد يزيد جهد الخلية.
- نوع المعدن المستخدم:
- تعتمد جهود الاختزال على نوع المعدن المستخدم. بعض المعادن تكون أكثر ميلًا للتأكسد، بينما يميل بعضها الآخر للاختزال بسهولة.
قانون نرنست لحساب جهد الخلية غير القياسي
عندما تكون الظروف غير قياسية (أي أن التركيزات ودرجة الحرارة تختلف عن الظروف القياسية)، يمكن استخدام قانون نرنست لحساب جهد الخلية.
أهمية حساب جهد الخلية
فهم كيفية حساب جهد الخلية يعتبر أمرًا حيويًا في مجال الكيمياء الكهروكيميائية. يمكن حساب جهد الخلية لمساعدة العلماء في تطوير تقنيات جديدة لتحويل الطاقة، مثل تطوير بطاريات أكثر كفاءة، وتحسين تفاعلات الطلاء الكهربائي، واستخدام تقنيات الحماية الكاثودية لمنع تآكل المعادن.
خلاصة
يُعد حساب جهد الخلية أداة أساسية في فهم كيفية عمل الخلايا الكهروكيميائية. من خلال معرفة جهود الاختزال لكل من المصعد والمهبط، يمكن التنبؤ بجهد الخلية ومعرفة ما إذا كان التفاعل تلقائيًا أم لا. بالإضافة إلى ذلك، يمكن استخدام معادلة نرنست لحساب جهد الخلية في الظروف غير القياسية.
احجز حصتك المجانية لتعلم الكيمياء الكهروكيميائية
إذا كنت ترغب في تحسين معرفتك بـ حساب جهد الخلية وتعلم كيفية تطبيقه في الحياة العملية، نحن نقدم لك دروسًا مخصصة مع معلمين ذوي خبرة. تواصل معنا الآن عبر واتس آب لحجز حصتك التجريبية المجانية والانطلاق في رحلة تعلم فعّالة وممتعة!


