الخلايا الجلفانية هي نوع من الخلايا الكهروكيميائية التي تعمل على تحويل الطاقة الكيميائية إلى طاقة كهربائية من خلال تفاعلات الأكسدة والاختزال. تُستخدم الخلايا الجلفانية في العديد من التطبيقات اليومية، مثل البطاريات والطلاء الكهربائي والحماية الكاثودية. في هذا المقال، سنستعرض كيمياء الخلايا الجلفانية وكيفية حدوث التفاعلات داخل هذه الخلايا.
ما هي الخلية الجلفانية؟
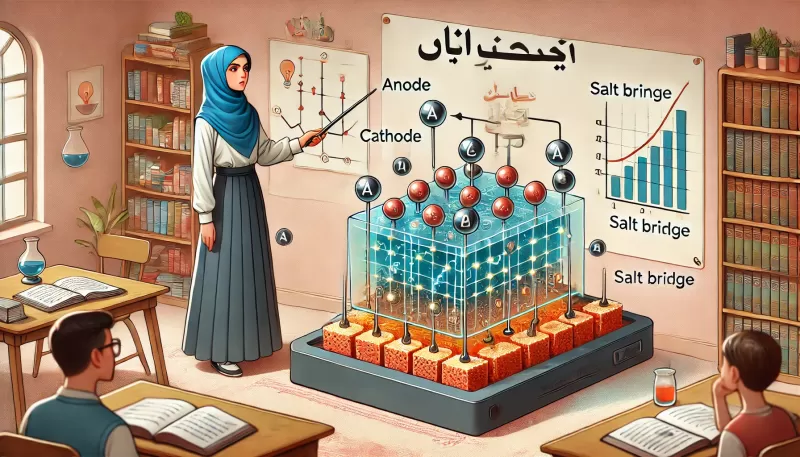
الخلية الجلفانية هي خلية كهروكيميائية تحتوي على قطبين (المصعد والمهبط) مغموسين في محلول إلكتروليتي، ويتم فصل الأقطاب عبر جسر ملحي أو حاجز نصف نفاذ. يحدث تفاعل أكسدة في القطب الأول (المصعد) وتفاعل اختزال في القطب الثاني (المهبط)، مما يؤدي إلى تدفق الإلكترونات من المصعد إلى المهبط عبر الدائرة الخارجية، وبالتالي إنتاج تيار كهربائي.
تركيب الخلية الجلفانية
- المصعد (Anode):
- هو القطب الذي يحدث فيه تفاعل الأكسدة. في هذا التفاعل، يفقد المعدن الإلكترونات ويتحول إلى أيونات تذوب في المحلول.
- مثال: في خلية الزنك والنحاس، يكون المصعد هو الزنك، حيث يتأكسد الزنك إلى أيونات الزنك (Zn^2+) ويفقد الإلكترونات.
- المهبط (Cathode):
- هو القطب الذي يحدث فيه تفاعل الاختزال. في هذا التفاعل، تكتسب الأيونات الإلكترونات وتتحول إلى مادة صلبة.
- مثال: في خلية الزنك والنحاس، يكون المهبط هو النحاس، حيث تكتسب أيونات النحاس (Cu^2+) الإلكترونات وتتحول إلى نحاس معدني.
- الجسر الملحي:
- يُستخدم الجسر الملحي لإكمال الدائرة الكهروكيميائية والسماح بمرور الأيونات بين نصفي الخلية. هذا الجسر يمنع التراكم المفرط للشحنات ويضمن استمرار التفاعل.
- الدائرة الخارجية:
- تقوم الإلكترونات بالانتقال من المصعد إلى المهبط عبر الدائرة الخارجية، وهو ما يولد التيار الكهربائي الذي يمكن استخدامه في تشغيل الأجهزة.
تفاعلات الأكسدة والاختزال في الخلايا الجلفانية
التفاعلات في الخلايا الجلفانية تعتمد على عمليتين رئيسيتين:
- الأكسدة: هي العملية التي يفقد فيها العنصر الإلكترونات. تحدث الأكسدة في المصعد.
- مثال: في خلية الزنك والنحاس:
- في هذا التفاعل، تكتسب أيونات النحاس الإلكترونات وتتحول إلى نحاس صلب.
كيفية عمل الخلية الجلفانية
تعمل الخلية الجلفانية على مبدأ اختلاف النشاط الكيميائي بين المعادن المستخدمة. المعادن التي تميل لفقد الإلكترونات (الأكثر نشاطًا) تكون عند المصعد، في حين أن المعادن التي تكتسب الإلكترونات تكون عند المهبط. هذا الاختلاف في النشاط يولد جهدًا كهربائيًا يحرك الإلكترونات عبر الدائرة الخارجية.
الخواص الكهروكيميائية
- جهد الخلية:
- يُقاس جهد الخلية الجلفانية باستخدام الفرق في الجهد الكهربائي بين المصعد والمهبط. يعتمد جهد الخلية على طبيعة المعادن المستخدمة وتركيز المحاليل.
- مثال: في خلية الزنك والنحاس، جهد الخلية هو حوالي 1.1 فولت.
- سلسلة النشاط الكهروكيميائي:
- تُستخدم سلسلة النشاط الكهروكيميائي لتحديد المعادن التي تكون أكثر عرضة للأكسدة أو الاختزال. المعادن التي تقع في الجزء العلوي من السلسلة تميل إلى فقد الإلكترونات (أكسدة)، بينما المعادن التي تقع في الجزء السفلي تميل إلى اكتساب الإلكترونات (اختزال).
تطبيقات الخلايا الجلفانية
- البطاريات:
- تُستخدم الخلايا الجلفانية في تصنيع البطاريات التي تُحول الطاقة الكيميائية إلى كهرباء لتشغيل الأجهزة الإلكترونية.
- مثال: بطاريات الليثيوم التي تُستخدم في الهواتف المحمولة تعتمد على تفاعلات جلفانية لتوليد الكهرباء.
- الطلاء الكهربائي:
- يتم استخدام الخلايا الجلفانية في عملية الطلاء الكهربائي لترسيب طبقات رقيقة من المعادن على الأسطح المعدنية لتحسين المظهر أو منع التآكل.
- مثال: طلاء الفضة على الأدوات المعدنية.
- الحماية الكاثودية:
- تُستخدم الخلايا الجلفانية في الحماية الكاثودية لحماية المعادن من التآكل، خاصة في الأنابيب والهياكل المعدنية تحت الأرض أو تحت الماء.
خلاصة
تُعد كيمياء الخلايا الجلفانية أساسًا لفهم كيفية تحويل الطاقة الكيميائية إلى طاقة كهربائية من خلال تفاعلات الأكسدة والاختزال. هذه الخلايا تلعب دورًا مهمًا في حياتنا اليومية من خلال تطبيقاتها العملية في البطاريات، الطلاء الكهربائي، والحماية الكاثودية.
احجز حصتك المجانية لتعلم الكيمياء الكهروكيميائية
إذا كنت ترغب في فهم كيمياء الخلايا الجلفانية بشكل أعمق وتعلم كيفية استخدام هذه المعرفة في الحياة العملية، نحن نقدم لك دروسًا مخصصة مع معلمين ذوي خبرة. تواصل معنا الآن عبر واتس آب لحجز حصتك التجريبية المجانية والانطلاق في رحلة تعلم فعّالة وممتعة!


